Case-report: het eerste beschreven geval van de ziekte van Tyzzer bij een veulen in Nederland
Tekst: L van den Wollenberg (Gezondheidsdienst voor Dieren, Deventer). MM. Meijer (Dierenartsenpraktijk Doetinchem-Zeddam) en E. van Garderen (Gezondheidsdienst voor Dieren, Deventer)
Een jong veulen vertoonde een klinisch beeld dat binnen korte tijd evolueerde van sloomheid en koorts naar koliekverschijnselen en neurologische symptomen, waarna het veulen in ogenschijnlijke doodsstrijd werd geëuthanaseerd. Bij pathologisch onderzoek werd de ziekte van Tyzzer vastgesteld. Deze case report beschrijft klinische symptomen, oorzaak, diagnostiek en achtergrond. Voor zover de auteurs in de literatuur hebben kunnen nagaan, is dit het eerste geval van de ziekte van Tyzzer dat beschreven is bij een veulen in Nederland.
Een KWPN-merrieveulen van vijf weken oud staat op een opfokbedrijf behorende bij een grote hengstenhouderij (± 160 dieren totaal, op het opfokbedrijf ca. 35 dieren). Het is het tweede veulen van een zesjarige merrie. De geboorte en daaropvolgende biestopname waren zonder problemen verlopen.
Begin mei 2022 wordt in de avond de dierenarts gebeld, omdat opvalt dat het veulen wat staat rond te kijken en minder actief is. De merrie heeft een vol uier. Als de dierenarts arriveert, stelt hij bij klinisch onderzoek een ademhalingsfrequentie vast van 30 per minuut, een polsfrequentie van 54 per minuut en een temperatuur van 40,4 graden Celsius; andere klinische parameters zijn niet afwijkend. Er wordt een serum amyloid A-waarde bepaald van 109 microgram per milliliter (µg/mL, ref. 0-20 µg/mL) (1) met een StableLab®-reader. Vervolgens wordt een behandeling gestart met procaïne-benzylpenicilline 15 milligram per kilogram lichaamsgewicht (mg/kg LG) intramusculair en flunixine meglumine 1,1 mg/kg LG intraveneus. Bij terugkomst op de kliniek wordt aanvullend bloedonderzoek uitgevoerd (SmartV5 bloedbeeld, Skyla Solution klinische chemie; Menarini Diagnostics). Meest opvallend afwijkende waardes die hierbij worden gevonden, zijn een uitgesproken leucopenie (WBC 1,6 G/l, ref. 9,4 ± 2,3 G/l), verhoogde leverwaardes (AST >1000, ref. 160 ± 19 U/L, totaal bilirubine 152 umol/L, ref. 24,8 ± 5,5 umol/L), een verhoogde spierwaarde (CPK 1144, ref. 128 ± 63 U/L) en een verhoogd creatininegehalte (302 umol/L, ref. 89 ± 18 umol/L) (2)
De volgende ochtend vroeg is de toestand van het veulen in eerste instantie uiterlijk onveranderd. Het veulen staat en doet een poging tot drinken. Na een uur vertoont het veulen echter koliekverschijnselen en als de dierenarts met spoed arriveert, zijn daarnaast ook neurologische verschijnselen zichtbaar. Het veulen heeft dan een temperatuur van 38,3 graden Celsius en ‘vuile’ slijmvliezen. Het veulen wordt behandeld met Buscopan® compositum (5 ml/100 kg LG), dexamethason (0,06 mg/kg LG) en er wordt een infuus met Sterofundin® toegediend. Tijdens het infuus krijgt het veulen nystagmus en lijkt in agonie te raken. Er wordt besloten het veulen te euthanaseren en naar de Gezondheidsdienst voor Dieren in te sturen voor postmortaal onderzoek.
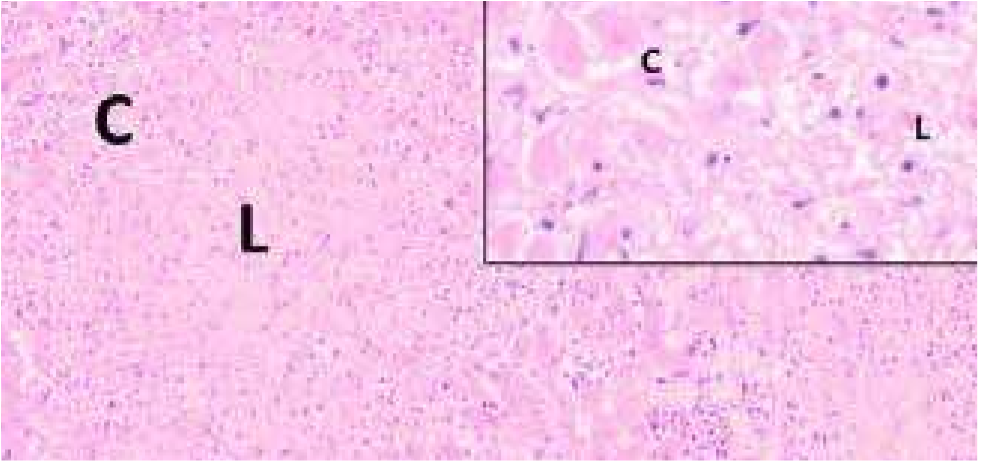
Figuur 1. Microscopisch beeld van het leverweefsel. C; coagulatienecrose van hepatocyten, L; lytische necrose van hepatocyten. De ‘insert’ geeft een meer gedetailleerd beeld van de coagulatie en lytische necrose van het leverparenchym. HE-kleuring.
Postmortaal onderzoek macroscopie
Het veulen verkeerde in een normale voedingstoestand. Het lichaam vertoonde icterus en verspreid puntbloedingen. De hersenvliezen waren hyperemisch. Er was sprake van enige overvulling van het pericard met heldere, iets visceuze vloeistof. Er was matig longoedeem en het hart toonde een wat bont gekleurd myocard. De lever was vergroot met bolle randen en had een geel-bonte kleur, macroscopisch waren geen duidelijke necrosehaardjes zichtbaar. Er waren aanwijzingen voor nierdegeneratie. Overige sectiebevindingen waren niet afwijkend.
Histopathologie
Microscopisch bleek het leverweefsel doorzaaid met necropurulente ontstekingshaardjes, waardoor ongeveer 40 procent van het leverparenchym verloren was gegaan. Aan de periferie van deze ontstekingshaardjes vertoonden de hepatocyten coagulatienecrose, in de meer centrale gedeelten lytische necrose, waardoor in het centrum van de ontstekingshaardjes alleen nog het reticulaire netwerk aanwezig was (figuur 1). Over het algemeen was rond de centraalvenen nog een smalle zoom van intact parenchym aanwezig. In de HE-kleuring werden geen virale insluitlichaampjes waargenomen. Voor zover het leverparenchym intact was, waren hier aanwijzingen voor hydropische degeneratie. Immunohistochemisch onderzoek op leptospirose en EHV1/EHV4 verliep negatief. Omdat de ziekte van Tyzzer onderdeel uitmaakt van de histopathologische differentieeldiagnose, is een aanvullende Warthin-Starry zilverkleuring uitgevoerd. Door middel van deze kleuring werd de aanwezigheid aangetoond van argyrofiele, naaldvormige intracellulaire bacteriën die de neiging hadden bundels te vormen, in de hepatocyten aan de periferie van de necrosehaardjes (figuur 2). Deze histopathologische bevindingen zijn pathognomonisch voor de ziekte van Tyzzer. Verder was in de cortex van de grote hersenen sprake van uitgebreid perivasculair oedeem, uitgebreide degeneratie van neuronen, verspreid acute necrose van neuronen en intracellulair oedeem in astrocyten. Deze microscopische veranderingen passen, in combinatie met de hierboven beschreven veranderingen in het leverweefsel, bij hepato-encefalopathie. Dit verklaart de klinisch waargenomen neurologische verschijnselen.
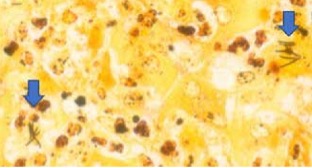
Figuur 2. Microscopisch beeld van het leverweefsel. Naaldvormige, zwart aankleurende (argyrofiele) intracellulaire bacteriën in necrotische hepatocyten (pijl). De vorm en rangschikking van deze bacteriën is kenmerkend voor Clostridium piliforme (voorheen Bacillus piliformis genoemd). Warthin Starry zilverkleuring.
Discussie
De ziekte van Tyzzer wordt veroorzaakt door Clostridium piliforme (voorheen Bacillus piliformis), een Gram-negatieve, obligaat intracellulaire sporevormende bacterie. De sporen van deze bacterie kunnen in de bodem en in mest voorkomen en kunnen bij meerdere diersoorten een infectie veroorzaken. Vooral bij knaagdieren en konijnen wordt de bacterie regelmatig gevonden. Zij zijn hierdoor een mogelijke bron van milieubesmetting. Bij paarden wordt de ziekte van Tyzzer sporadisch vastgesteld, maar soms worden meerdere gevallen op één bedrijf gevonden als cluster. De ziekte wordt bij paarden voornamelijk gekenmerkt door een acute, necrotiserende hepatitis bij jonge veulens (meestal <45 dagen, een enkele keer ouder) die snel progressief verloopt. Minder frequent worden ook necrotiserende colitis en myocarditis vastgesteld. De meest waarschijnlijke infectieroute is via inname van sporen bevattende mest of grond met daaropvolgende kolonisatie van de darm, waarna via de portale circulatie infectie van de lever optreedt. De klinische symptomen variëren: soms worden veulens dood aangetroffen in de wei zonder voorafgaande verschijnselen, in andere gevallen vertonen geïnfecteerde veulens snel oplopende hoge koorts, shock en soms centraal nerveuze verschijnselen (door hepatoencephalopathie) en overlijden dan over het algemeen binnen 24 tot 48 uur. Een enkel veulen vertoont tijdens het ziekteverloop geelzucht en ernstige diarree. Succesvolle behandeling van een veulen is tot op heden slechts gemeld in één vermoedelijk geval (Peek et al. 1994) en in één bevestigd geval (Borchers et al. 2006) van de ziekte van Tyzzer. Volwassen paarden worden zelden ziek, maar kunnen wel drager zijn en zo via de mest een besmettingsbron vormen voor veulens, waarbij coprofagie in de eerste levensweken tenslotte een normaal verschijnsel is. In laboratoriumknaagdieren is aangetoond dat uitbraken van de ziekte van Tyzzer nauw samenhangen met stressvolle handelingen, een verminderde afweer en een toename van de hoeveelheid sporen in de omgeving. Bij veulens wordt daarnaast als predisponerende factor onder andere een minder adequate biestvoorziening genoemd. Veulens van oudere merries en van merries die al langer op een bedrijf aanwezig zijn, blijken een kleinere kans te hebben op het ontwikkelen van het ziektebeeld dan veulens van jonge merries of ‘gast’-merries, hetgeen een rol van de hoeveelheid en kwaliteit van biestopname suggereert. Verder hebben voedingsfactoren waarschijnlijk invloed: veulens van merries die een zeer eiwitrijkdieet gevoerd krijgen, lopen namelijk een groter risico. Dit wordt waarschijnlijk veroorzaakt doordat de bacterie zich met name vermenigvuldigt in de darmen van volwassen dieren die drager zijn, als zij een heel ‘rijk’ dieet krijgen aangeboden. Een definitieve diagnose van de ziekte van Tyzzer wordt meestal gebaseerd op histologisch onderzoek, waarbij dan intrahepatocellulaire filamenteuze bacteriën worden vastgesteld in de periferie van de laesies in de lever. Clostridium piliforme is slecht zichtbaar met routine kleuringsmethoden; detectie wordt aanzienlijk vergemakkelijkt door het gebruik van zilverkleuringen zoals een WarthinStarry kleuring. De bacterie is obligaat intracellulair en daardoor erg moeilijk te kweken, hetgeen het stellen van een de antemortem diagnose moeilijk maakt. Recent is echter in de literatuur melding gemaakt van succesvol gebruik van ‘polymerase chain reaction’ (PCR)-techniek als hulpmiddel bij diagnose van Clostridium piliforme-infectie bij paarden, hetgeen mogelijk een waardevolle rol kan gaan spelen in een vroege identificatie van Clostridium piliforme-infectie bij veulens.
Conclusie
De ziekte van Tyzzer wordt bij veulens tot op heden zelden vastgesteld, het hoort echter in de differentiële diagnose van acute ziekte en sterfte. Hoewel het sterftecijfer van de ziekte hoog is, is een succesvolle behandeling niet ondenkbaar indien intensieve zorg en antimicrobiële therapie onmiddellijk worden gestart. Een snelle diagnose door middel van bijvoorbeeld PCR-diagnostiek zou hierbij behulpzaam kunnen zijn. Hygiënische milieuomstandigheden en een goede voorziening van biest van hoge kwaliteit blijven vooralsnog de belangrijkste manieren om de ziekte van Tyzzer te voorkomen.
Referenties
- Equine inflammatory markers in the twenty-first century, a focus on Serum Amyloid A, A. Long and R. Nolen-Walston, Vet Clin North Am Equine Pract. 2020;36:147–160.
- Haematological and blood biochemical characteristics of Dutch Warmblood foals managed under three different rearing conditions from birth to 5 months of age, H. Brommer, M. M. Sloet van Oldruitenborgh-Oosterbaan and B. Kessels. Vet Quart; 2001;23:92-5.
- Clostridium piliforme infection (Tyzzer disease) in horses: retrospective study of 25 cases and literature review, J.A. García, M.A. Navarro, K. Fresneda, F.A. Uzal. Journal of Veterinary Diagnostic Investigation 2022;34:421–428.
- Neonatal hepatic failure in a Thoroughbred foal: successful treatment of a case of presumptive Tyzzer’s disease, S. F. Peek,T. D. Byars,E. Rueve. Equine Vet. Ed. 1994;6:307-309.
- Successful treatment and Polymerase Chain Reaction (PCR) confirmation of Tyzzer’s Disease in a foal and clinical and pathologic characteristics of 6 additional foals (1986–2005), A. Borchers, K.G. Magdesian, S. Halland, N. Pusterla and W.D. Wilson. J Vet Intern Med 2006;20:1212–1218.
- The first case of Tyzzer’s disease in a young foal in Italy: a case report, N. Ellero, A. Lanci, G. Avallone, J. Mariella, C. Castagnetti, L.V. Muscatello, C. Di Maio and F. Freccero. Veterinaria Italiana 2021;57:239-246.
- Tyzzer’s disease in foals: Retrospective studies from 1969 to 2010, T.W. Swerczek. Can Vet J 2013;54:876–880.
- Tyzzer’s disease in an 1 1-day-old foal, K.A. St. Denis, N. Waddell-Parks, M. Belanger. Can Vet J 2000;41:491-492.
- Tyzzer’s disease in the foal: Case reports and review, G.W. Thomson, R.W. Wilson, E.A. Hall and P. PhysickSheard. Vet. J., 1977;18:41-43.





